급성 심부전의 치료
Abstract
The prevalence of heart failure (HF) is rapidly increasing throughout the world, and is closely associated with serious morbidity and mortality. In particular, acute HF is one of the main causes of hospitalization and mortality, especially in elderly individuals. In Korea, the socioeconomic burden of HF is substantial. Because of this, the Korean HF society developed chronic and acute HF management guidelines in 2017, adapted process while including as much data from Korean studies as possible. The scope of the current review, which is based on the Korean HF guidelines, includes the definition, diagnosis, and treatment of acute HF with reduced or preserved ejection fractions of various etiologies.
Key Words: Heart failure; Guideline; Medication therapy management
서 론
한국 심부전 유병률은 2002-2013년 기간 동안 연령의 증가에 따라 기하급수적으로 증가하고 있으며, 특히 여자에서 유병률이 증가하고 있다[ 1]. 특히 40-59세에 비하여 60세 이상에서 급증하며 80세 이상 연령군에서의 유병률은 12.56%이며 2040년에는 전체 유병률이 2015년 기준 1.6%에서 3.35%로 매우 높게 증가할 것으로 예측되고 있다. 이는 뇌경색을 포함한 뇌혈관질환과 더불어 고령화 단계에서 지속적인 증가가 예상된다. 급성 심부전(acute heart failure)은 미국에서 매년 약 550,000예가 새롭게 진단되며 이 질환으로 인하여 매년 약 250,000명이 사망한다고 알려져 있으며[ 2], 미국 국가단위 퇴원환자 분석 자료상에도 나이를 보정한 급성 심부전 입원율이 지속적으로 증가하고 있는 추세이다[ 3]. 급성 심부전 예후는 매우 나쁜 것으로 보고되는데, 국내 연구 결과에서는 원내 사망률이 6.1%였고, 1년, 4년 사망률은 각각 15%, 30%로 예후가 불량하다. 재입원율은 1개월 이내가 6.4%, 6개월 이내가 24%로 보고되었다. 또한 급성 심부전으로 8일 입원하는 동안 약 770만 원 정도의 비용이 드는 것으로 보고되어 급성 심부전이 많은 사회경제학적 비용을 초래하는 질환임을 알 수 있었다[ 4]. 따라서 급성 심부전 환자들에 대한 치료목표는 증상 완화, 혈역학적 안정 및 신경 호르몬계의 정상화에 따른 사망률 감소에 있다. 본 고찰에서는 급성 심부전에 대하여 2017년 발표된 대한심부전학회 치료지침을 기반으로 최근 정립된 진단, 예후예측과 치료 약제에 대한 기술 및 관련 임상 연구 결과들에 대해 기술하고자 한다.
본 론
1. 국내 급성 심부전 환자들의 특징
국내 급성 심부전 환자들을 대상으로 한 코호트 연구에 의하면 52% 정도가 신생 급성 심부전(acute de novo heart failure [HF])이며, 나머지 48%는 만성 심부전의 악화로 발현하였다. 주요 동반질환으로는 고혈압, 당뇨병 그리고 심방세동이며, 급성 심부전의 원인질환으로 허혈심장병, 심근병증, 판막성심장병, 빈맥유발성 심근병증이 주요 원인이었다[ 5].
2. 급성 심부전의 정의 및 분류
심부전은 전형적인 증상(호흡곤란, 발목부종, 피로감 등)과 징후(경정맥압 상승, 폐수포음, 말초부종 등)가 있으면서 심장의 구조적 또는 기능적 이상에 의하여 발생하는 임상군이며, 안정시 또는 부하조건에서 심박출량의 저하, 또는 심장내압의 상승이 유발된 상태를 의미한다.
심부전 환자가 최소 한 달 이상 상태의 변화가 없을 때 안정기로 정의하며, 이런 안정기 심부전 환자가 증상 혹은 징후가 급격히 악화되는 경우를 비대상성 급성 심부전(acute decompensated HF)이며, 심부전이 처음 발현된 경우를 신생 급성 심부전(acute de novo HF)으로 분류한다. 치료적 접근과 관련하여 임상상태에 따른 분류가 매우 중요하다. 신체검사를 통하여 울혈 상태에 따라 습(wet) 혹은 건(dry), 조직관류상태에 따라 온(warm) 혹은 냉(cold)의 두 지표를 이용하여 분류하는 Forrester 분류법에 따라 4개의 군으로 나눈다( Fig. 1) [ 6]. 울혈의 정도를 확인하고 평가하기 위해서 경정맥압력의 상승 여부, 복수나 부종의 유무를 평가하고 흉부청진에서 폐의 수포음이나, 심음 이상 등의 유무를 확인하고 단순흉부방사선사진을 통하여 폐부종 및 심장비대 등을 확인한다. 조직관류저하는 피부온도 저하, 소변량 감소, 의식 저하 등을 통하여 확인할 수 있다. 울혈의 평가를 가장 잘 반영하는 지표는 폐모세혈관쐐기압(pulmonary capillary wedge pressure, PCWP)이며 관류를 잘 반영하는 지표는 심장박출계수(cardiac index, CI)이다.
3. 급성 심부전의 원인 및 악화 요인
급성 심부전 환자들을 치료하는 데 있어 심부전 악화인자를 파악하고 교정하는 것은 매우 중요하다( Table 1). 또한 초기에 긴급한 치료를 요하는 원인을 찾는 것이 매우 중요한데, 급성 심부전의 원인과 유발인자 관점에서 즉각적인 치료가 필요한 다섯 가지 임상상태인 급성 관상동맥증후군, 고혈압성 응급증, 빈맥/심한 서맥/전도 장애, 구조적 손상, 급성 폐색전증 등을 따로 분류하기도 한다[ 7]. 급성 심부전 환자들의 입원 원인들 중에서 가장 흔한 원인으로 약물 복용을 자의로 중단하거나, 혹은 저염식이 불이행 등과 같은 표준적인 치료적 생활습관 교정의 중단이 많아 지속적인 교육이 중요하다.
4. 초기 평가 및 진단적 접근
먼저 치료에 앞서 환자의 산소포화도, 혈역학적 상태, 신체조직으로의 관류 상태 대한 평가가 신속하게 진행되어야 한다. 기초검사로 기본 혈액검사와 더불어 흉부 방사선검사, 심전도검사, 나트륨이뇨펩티드(natriuretic peptide, B-type natriuretic peptide [BNP] or NT-pro BNP) 검사, 심장 초음파검사가 필요하다. 주의할 점은 흉부 방사선검사는 폐울혈, 가슴막삼출 및 심장비대가 비교적 특징적인 소견이나 약 20%의 환자에서는 정상으로 관찰될 수 있다. 급성 심부전 환자에서 정상 심전도는 매우 드물며 기저 심장질환 및 유발요인을 확인하는데 유용하다. 즉각적인 심장 초음파검사는 심장성쇼크 등의 혈역학적 불안정 상태나 구조적 손상, 급성 판막 역류 또는 대동맥박리 등의 급성 사망의 가능성이 높은 구조적 또는 기능적 심장질환에서는 필수적이다. 처음 발생한 심부전이나 심장기능에 대한 정보가 없는 환자에서는 조기에 심장 초음파검사를 고려하여야 한다. 임상상태의 변동이 뚜렷하지 않다면 반복적인 심장 초음파검사는 통상적으로 필요하지 않다.
나트륨이뇨펩티드는 급성 심부전 환자에서 진단 또는 감별 진단을 위하여 사용되며 특히 호흡곤란의 원인이 명확하지 않은 경우에 유용하다. 급성 호흡곤란으로 응급실에 온 환자를 대상으로 한 연구들에서 나트륨이뇨펩티드는 높은 진단 정확도와 음성예측도를 보였으며, 이는 박출률 저하 심부전과 박출률 보존 심부전에서 모두 유용하였다[ 8- 12]. 나트륨이뇨펩티드는 호흡곤란 등의 급성 심부전이 의심되는 임상상황에서 급성 심부전에 의한 원인을 감별하는 데 매우 유용하며 BNP 100 pg/mL 또는 NT-proBNP 300 pg/mL 이상으로 상승된 경우, 급성 심부전으로 진단할 수 있다[ 13- 15]. 주의할 점은 이러한 나트륨이뇨펩티드가 상승하는 심장성 또는 비심장성 요인이 있기 때문에 나트륨이뇨펩티드 상승만으로 급성 심부전을 진단해서는 안 되며 임상양상과 다른 검사실 소견을 함께 고려해야 한다( Table 2) [ 16- 18]. 대혈관성 뇌경색의 경우 심혈관 질환 없이 급성기에 나트륨뇨폡티드의 수치가 상승할 수 있으며, 이런 경우 뇌경색의 범위가 크고 나쁜 예후를 보일 수 있어 동반된 심방세동 또는 구조적, 기능적 심장평가를 시행할 필요가 있다. 심근 표지자인 트로포닌은 급성 심부전 환자에서 명확한 심근허혈 또는 협착성 관상동맥질환이 없는 경우에도 상승한다. 트로포닌의 상승은 심근 손상이 지속되거나 또는 괴사가 진행 중인 것을 의미한다. 급성 심부전 환자에서 이러한 트로포닌이 상승한 경우 입원 중 및 퇴원 후 사망률이 증가한다고 보고되었으며, 치료과정 중 트로포닌이 감소하는 경우에는 계속하여 상승된 경우에 비하여 더 좋은 예후를 보인다고 알려져 있다[ 19]. 이외에 심근 섬유화 표지자인 Soluble ST2와 galectin-3가 연구되었으며 이는 심부전 환자에서 입원율과 사망을 예측할 뿐만 아니라 나트륨이뇨펩티드에 부가하여 심부전 진단에 추가적인 유용성을 보인다고 알려져 있다[ 20, 21]. 따라서 증상, 징후, 환자 상태 및 초기 검사 결과를 토대로 아래 그림과 같은 급성 심부전 의심 환자의 진단적 접근을 제시할 수 있다( Fig. 2).
5. 급성 심부전의 치료
급성 심부전은 수분 저류와 말초동맥 수축 및 심장내압의 상승하는 혈역학적 질환이며 혈역학적 상태의 악화로 인하여 임상적 울혈로 진행하여 입원하게 된다. 치료목표는 증상 완화와 더불어 세포외액(extracellular fluid) 과다를 감소시키고 혈역학적 상태를 호전시켜 좌심실 및 우심실 충만압 감소와 더불어, 심박출량 증가 및 필수 장기에 대한 관류 유지가 치료의 목적이 된다. 심장성쇼크 또는 호흡부전 상태로 응급조치가 필요한 경우 순환보조를 위한 약물 치료와 함께 필요시 기계적 보조(mechanical circulatory support) 또는 기계환기(mechanical ventilation)를 시행하며 초기 단계에서 즉각적인 치료가 필요한 다섯 가지 임상상태인 급성 관상동맥증후군, 고혈압성 응급증, 빈맥/심한 서맥/전도 장애, 구조적 손상, 급성 폐색전증에 해당하는 경우에는 각 질환에 표준적 치료를 응급으로 시행하게 된다. 이후 급성 심부전의 임상적 분류( Fig. 1)에 따라 치료를 시행한다. 즉, 폐모세혈관쐐기압와 심장박출계수에 따라 온/냉, 습/건으로 분류하게 되며 온/습의 경우 울혈 소견이 있으며 관류 장애가 없는 상태로 혈압의 상승이 주된 기전인 경우에는 이뇨제 사용과 더불어 혈관확장제를 사용하며, 울혈 위주의 경우 이뇨제, 혈관확장제 사용과 더불어 초미세여과법(ultrafiltration)을 고려할 수 있다. 냉/습의 경우 울혈과 관류 장애가 있는 상태로 저혈압이 없는 경우에는 혈관확장제 사용과 더불어 이뇨제를 사용하며 반응이 없는 경우 강심제를 사용한다. 냉/습이면서 저혈압이 동반된 경우에는 초기 강심제 사용과 더불어 이뇨제를 사용하며 반응이 없는 경우 기계적 순환보조를 시행한다. 온/건의 경우 울혈의 증거가 없으며 관류가 유지되는 경우로 표준적인 경구 심부전 약물을 조절하며 냉/건의 경우 울혈 소견은 없으나 관류가 저하된 경우로 일차적으로는 저혈량성의 상태를 의미하며 수액을 공급하며 경과를 관찰하여 재평가하게 된다[ 7].
6. 치료 약물
일반적인 원칙으로, 급성 비보상성 좌심실 수축 부전 심부전(acute decompensated HF with reduced LVEF) 환자에서는 표준 심부전 약물인 베타 차단제(β-blocker), 안지오텐신전환효소 차단제(angiotensin converting enzyme inhibitor) 또는 안지오텐신수용체 길항제(angiotensin receptor blocker)는 혈역학적으로 불안정하지 않고 금기증이 없다면 지속 투여한다. 초기에 사용한 주사용 이뇨제, 혈관확장제 및 강심제를 중단하고 체내 혈액량이 적정 수준으로 유지되어 환자가 안정되었다면, 베타 차단제를 저용량부터 시작하며, 항응고제 사용에 따른 임상적 이득이 위험에 비하여 높다면 정맥 혈전색전증 예방을 위하여 항응고제를 사용하는 것이 제시된다.
1) 이뇨제(diuretics)
울혈 상태의 환자는 경구 약물의 장을 통한 생체이용률(bioavailability)이 감소하여 고리이뇨제(loop diuretics)를 경구로 투여하더라도 기대한 효과를 얻지 못한다. 따라서 고리이뇨제는 정맥 주사로 사용하며, 좌심실 박출률과 관계없이 울혈 증상을 신속하게 감소시키고 용적 과부하를 해소하기 위하여 권장되며 응급실 내원 당시부터 즉시 투여하는 것이 권고된다. 고리이뇨제가 효과적이지 못하면 다른 계통의 이뇨제인 티아지드(thiazide diuretics) 또는 알도스테론수용체 차단제(mineralocorticoid receptor antagonist)를 이뇨용량으로 추가할 수 있으나 [ 22, 23] 전해질불균형, 신기능 장애, 저체액증에 대한 주의와 입원 중 악화된 경우에는 염분 섭취량 평가 및 투여 중인 수액 제제에 대하여 조정이 필수적이다. 이뇨제의 용량과 투여 경로를 비교한 연구에서 단일 용법(bolus), 지속정맥주입(continuous intravenous infusion), 혹은 저용량(low dose), 고용량(high dose) 용법 모두가 효과와 임상적 결과에 차이가 없다고 보고되었다[ 24]. 따라서 기존 심부전 환자에서는 furosemide 20-40 mg을 정맥 주사할 것을 권고하고 있다.
2) 혈관확장제(vasodilator)
정맥 주사용 질산염(nitrate)은 정맥확장 효과를 통하여 심장의 전 부하를 낮추어 폐 울혈을 빠르게 감소시키는 데 도움이 된다. 따라서 고혈압, 관상동맥허혈, 의미 있는 승모판 역류가 있는 심부전 환자에서 질산염 정맥 주사를 사용하였을 때 호흡곤란 완화에 도움이 될 수 있다. 니트로푸루시드(nitroprusside)는 전부하를 감소시키는 정맥확장 효과와 후 부하를 감소시키는 동맥확장 효과가 균형을 이루는 특징이 있으나 티오시안산염(thiocyanate) 독성으로 식욕 저하, 전신무력감과 의식 변화를 초래할 수 있으며 신장기능 저하가 있는 환자에서는 주의를 요한다. 네시리타이드(nesiritide)는 좌심실 충만압을 감소시켜 주는 작용으로 호흡곤란을 완화시키지만 저혈압 발생을 주의해야 한다. 주사용 혈관확장제는 급성 심부전 환자에서 예후를 향상시키지는 못하며 단지 호흡곤란을 완화시키기 위하여 제한적으로 사용할 수 있다. 특히, 주사용 혈관확장제의 사용으로 혈압이 지나치게 저하되면 급성 심부전 환자에서 사망률이 증가할 수 있으므로 증상과 혈압의 변화를 면밀하게 모니터링하여야 한다( Table 3) [ 24].
3) 주사용 강심제(inotropes) 및 혈관수축제(vasoconstrictor) (Table 4)
주사용 강심제는 심박출량을 증가시키는 약제로 급성 심부전 치료의 근간이 되었던 약제이지만 임상적 효용성에 대한 근거는 부족하며 부정맥이나 심근허혈을 유발하는 등의 부작용이 발생할 수 있어 낮은 심박출량으로 조직관류가 심하게 저하된 경우에만 사용하여야 한다. 도부타민(dobutamine)은 심근 수축력을 증가시키는 약제로 심박출량이 심하게 감소하여 주요 장기에 혈류공급이 심하게 저하되고 쇼크 상태로 혈압이 낮은 환자들에게 주로 사용하지만 심박동수를 증가시켜 심근허혈 및 부정맥을 유발할 수 있어 주의가 필요하다. 베타 수용체에 작용하지 않는 포스포디에스테라제 억제제(phosphodiesterase inhibitor)인 밀리논(milrinone)은 이론적으로 베타 차단제를 사용하고 있는 경우에도 사용할 수 있고 폐동맥저항을 낮출 수 있다는 장점이 있으나 전신 혈압을 낮출 수 있다. 레보스민단(levosmendan)은 비교적 최근에 개발된 강심제로 유럽에서는 도부타민에 비하여 우선적 사용이 권고되며 특히 저관류의 원인으로 베타 차단제의 사용이 의심되는 경우 유효하나 동시에 혈관확장제로 작용하기 때문에 저혈압(systolic blood pressure [SBP] <85 mmHg) 또는 심장성쇼크 환자에서는 혈관수축제와 병용이 필요하다[ 25- 27]. 한국에는 아직 도입이 되지 않았다. 장기간 주사용 강심제 사용은 예후에 대한 연구에서는 사망률을 증가시킬 수 있어 일반적으로 권고되지 않으나 심장이식 전 단계에서 교량 치료로 고려할 수 있으며, 저용량으로 시작하고 용량 조절이 필요하다[ 28- 30]. 노르에피네프린(norepinephrine) 및 에피네프린(epinephrine)과 같이 말초동맥에 작용하는 혈관수축제는 심한 저혈압이 동반된 중증 환자에서 사지 말단 부위로 공급되는 혈류량을 줄여 주요 장기들로 가는 혈류를 유지시키는 역할을 한다. 그러나 좌심실의 후부하는 증가하고, 장기간 사용시 주사용 강심제와 마찬가지로 부작용이 증가하므로 적절한 심실 충만압에도 불구하고 주요 장기에 지속적으로 혈류공급이 원활하지 못한 환자들에게만 제한적으로 사용하여야 한다. 도파민(dopamine)은 비교적 고용량(>5 μg/kg/min)에서 심근 수축력을 증가시키고, 혈관을 수축시켜 전신 혈압을 증가시키고 이보다 낮은 용량(<3 μg/kg/min)에서는 선택적으로 신장혈관을 확장시킬 수 있어 소변량을 증가시킬 수 있다.
4) 항부정맥제(antiarrhythmic drugs)
급성 심부전 환자에서 빈맥성 부정맥 치료를 위하여 디곡신(digoxin), 아미오다론(amiodarone)을 사용할 수 있다. 디곡신은 박동수 조절을 위해서 고려할 수 있는 첫 번째 약제로 심박수가 분당 110회 이상일 때 사용할 것이 권고되며, 이전에 디곡신을 쓰지 않았던 환자에서 0.25-0.5 mg을 정맥 주사로 사용할 수 있다. 신기능 이상이나 전해질 불균형이 동반되어 있는 경우 부정맥 유발 가능성이 증가함으로 주의가 필요하다. 아미오다론은 여러 연구에서 사망률을 증가시키지 않았기 때문에 급성 심부전 환자에서 심방, 심실 부정빈맥을 조절하기 위해서 사용을 고려할 수 있다[ 31, 32].
5) 기타 약물 치료
경구 용 바소 프레신 길항제(vasopressin selective V2-antagonists)인 톨밥탄(tolvaptan)은 신장의 집합요세관에서 순수한 수분 재흡수를 억제하여 이뇨제 치료에 반응하지 않는 용적과부하 상태의 심부전 치료에 사용할 수 있다. 또한 저나트륨혈증을 동반한 용적과부하인 심부전 환자에서 효과적으로 저나트륨혈증을 개선시켰다. 수분섭취 제한을 포함한 적절한 치료에도 불구하고 중증 저나트륨혈증이 지속되는 급성 심부전 환자에서 톨밥탄 치료를 고려할 수 있다[ 33].
7. 기구 치료 및 수술 요법
1) 초미세여과법(ultrafiltration)
급성 심부전 환자에서 수분저류를 동반한 경우 체내수분 감소와 울혈 증상 개선을 위하여 초미세여과법을 고려할 수 있다. 초미세여과법은 침습적 치료로, 치료자의 경험, 신장내과 의사 자문, 추가 비용 등을 고려해야 하며, 주로 이뇨제를 포함한 내과적 치료에 반응하지 않는 일부 급성 심부전 환자에서 과잉수분 제거 목적으로 시행할 수 있다[ 34- 36].
2) 대동맥내풍선펌프(intra-aortic balloon pump)
급성 심근경색증과 심장성쇼크가 동반되는 경우 대동맥내풍선펌프의 사용을 고려할 수 있으나, 모든 환자에서 일괄적인 사용은 권고되지 않는다. 심실중격결손이나 꼭지근 파열 같은 기계적 합병증에 의한 심장성쇼크를 동반한 급성 심근경색증 환자들의 경우에는 현재 대규모 무작위 연구 결과는 없지만 일부 단일기관 보고들이나 후향적 관찰 연구 결과 등을 토대로 할 때, 수술적 교정 전 혈역학적 안정화를 위한 가교역할로서 대동맥내풍선펌프의 사용은 도움이 될 수 있다[ 37, 38].
3) 기계적 순환보조장치 및 심장이식
급성 심부전 환자, 좌우심실 심부전이 동반되어 있는 환자에서, 약물 치료에 불응하여 심장성쇼크로 진행되는 경우 에서 체외형 생명구조장치(extra corporeal life support, ECLS)를 사용할 수 있다. 체외막형산소섭취(extra corporeal membrane oxygenation, ECMO)로 대표되는 체외형 생명구조장치는 2000년 Bartlett 등[ 39]이 심장성쇼크에서 44%의 생존율 향상을 보고하면서 그 사용이 증가하기 시작하였고, 2003년 Chen 등[ 40]이 심장질환으로 인한 급성 심정지에서 심폐소생술시 체외형 생명구조장치의 사용이 생존율을 유의하게 증가시킨다는 것을 보고한 이후 급성 심부전에서 체외형 생명구조장치의 사용은 보편화되고 있다. 혈역학적으로 불안정하고 타장기 손상이 의심되는 환자에서 심장이식이나 좌심실보조장치 사용을 결정하기 전 경피적 심실보조장치(percutaneous ventricular assist device, pVAD)를 삽입하는 것을 고려할 수 있다. 그러나 현재까지는 대동맥내풍선장치에 비하여 사망률을 호전시켰다는 임상적 근거는 부족하여 선택적으로 적용할 필요가 있다[ 41, 42]. 심장이식은 약물 치료에 불응하는 말기 심부전 환자에서 가장 근본적인 치료로 만성 심부전 상태에서 이식이 결정되는 경우가 일반적이지만, 일부 급성 심부전 및 심장성쇼크, 심정지로 기계적 순환보조장치 삽입 후 이를 성공적으로 제거하지 못하는 경우 이식을 진행하기도 한다. 하지만 이 경우 심장이식 전 환자 상태에 대한 충분한 평가가 이루어지지 못한 고 심장이식 수술이 진행되므로 이식 후 장기적인 예후가 좋지 않은 것으로 알려져 있어서 심장이식 수술에 대한 결정을 신중히 해야 한다. 특히 심정지나 쇼크의 환자의 경우, 가역적인 신경학적 회복 여부에 대한 판단이 어려운 경우가 많아 기계적 순환보조장치 또는 심장이식 시행 전에 신경집중 치료전문가의 협의가 매우 중요하다.
8. 퇴원 후 치료
급성 심부전 환자는 퇴원 전, 포괄적인 수행평가(performance measurement)가 이루어져야 한다. 세부적으로는 급성 악화인자에 대한 평가와 교정 여부, 울혈을 비롯한 심부전의 증상 및 징후의 해소 여부, 경구 이뇨제 용량이 안정적으로 유지되는지, 심부전의 예후를 개선시키는 필수 약제의 적절한 용량 투여 여부, 약제의 주의사항과 용법에 대한 환자 교육 여부, 환자에게 필요한 시술이나 수술이 입원 기간 동안 충분한 수행되었는지, 동반질환에 대하여 적절한 평가와 치료 시행 여부, 금연이나 식사, 운동 조절에 대한 교육과 더불어, 환자나 보호자 스스로 관리할 수 있는 능력이 충분히 확보되어 있는지 여부를 평가한다. 따라서 다학제적인 심부전 접근(multidisciplinary team approach)이 중요하다. 우리나라의 급성 심부전 환자들의 코호트(KorHF) 연구 데이터를 분석한 결과, 포괄적 수행평가는 환자의 예후를 결정하는 데 매우 중요하다는 사실을 알 수 있다[ 43]. 환자가 퇴원한 후에도 심부전 특수 클리닉을 통하여 의사, 심부전 전문 간호사, 영양사, 운동 치료사 등이 환자를 지속적으로 모니터링해야 하며 이는 심부전 환자들의 사망률 및 재입원율을 감소시키는데 중요한 역할을 한다.
결 론
급성 심부전 증후군 환자들은 초기 평가와 치료가 매우 중요하며 혈역학적 지표인 심실충만압과 관류상태에 따라 적절한 치료지침을 적용해야 한다. 나트륨뇨펩타이드는 급성 심부전의 감별진단에 매우 유용한 표지자로 신속한 치료전략을 수립하는데 유용하다. 응급 치료가 필요한 급성 관상동맥증후군, 고혈압성 응급증, 빈맥/심한 서맥/전도 장애, 구조적 손상, 급성 폐색전증에 대한 일차적 감별진단이 필수적이다. 울혈 증상 감소를 목적으로 고리이뇨제를 신속히 정맥 주사해야 한다. 이뇨제 치료에 저항성을 보일 경우에는 초미세여과법을 고려해 볼 수 있으며 심근수축제의 사용은 심박출량이 감소되어 조직으로의 관류가 부족한 경우 일시적으로 사용할 수 있으며 약물저항성 쇼크가 지속되는 경우 기계적 순환보조장치가 필요할 수 있다. 급성 심부전 치료와 더불어 퇴원 전 환자에 대한 포괄적 수행평가를 통하여 급성 심부전 환자들의 사망률 및 재입원율을 감소시키고 삶의 질을 향상시키는 데 도움이 될 수 있을 것이다.
Figure 1.
Clinical assessment of acute decompensated heart failure 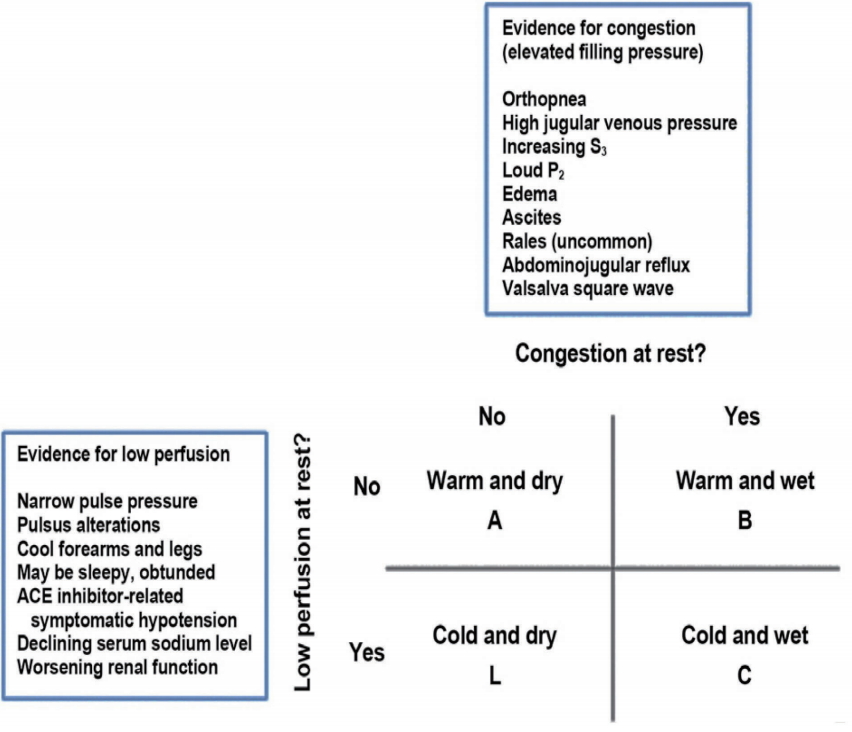
Figure 2.
Diagnostic approach in patient suspicious acute heart failure. ECG, electrocardiogram; BNP, B-type natriuretic peptide. 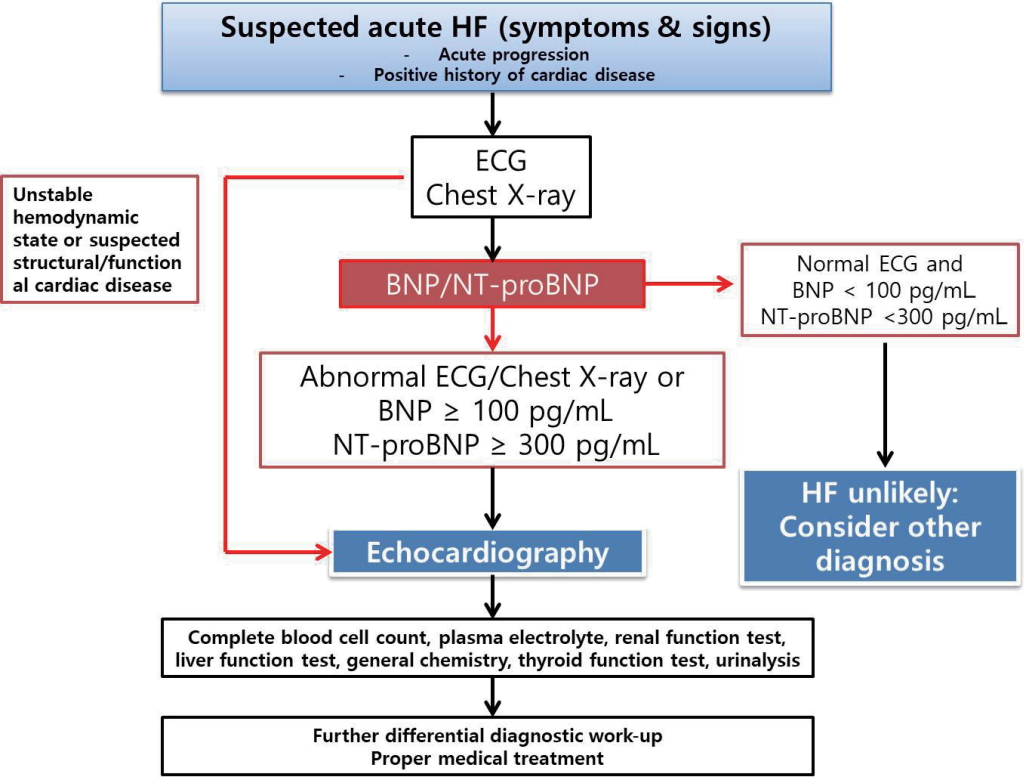
Table 1.
Aggravating factors of acute heart failure
|
Aggravating factors of acute heart failure |
|
Acute coronary syndrome |
|
Arrhythmia (tachyarrhythmia: atrial fibrillation, ventricular tachycardia, bradyarrhythmia: conduction abnormality) |
|
Excessive elevation of blood pressure |
|
Non-adherence with salt/fluid intake or medication |
|
Toxic substances(alcohol, recreational drugs) |
|
Drugs (e.g., NSAIDs, corticosteroids, negative inotropic substances, cardiotoxic chemotherapeutics) |
|
Exacerbation of chronic obstructive pulmonary disease |
|
Pulmonary embolism |
|
Infection (e.g., pneumonia, infective endocarditis, sepsis) |
|
Surgery and perioperative complications |
|
Increased sympathetic drive, stress-related cardiomyopathy |
|
Metabolic/hormonal derangements(e.g. thyroid dysfunction, diabetic ketosis, adrenal dysfunction, pregnancy and peripartum-related abnormalities) |
|
Cerebrovascular insult |
|
Acute mechanical cause: myocardial rupture complicating ACS (free wall rupture, ventricular septal defect, acute mitral regurgitation), chest trauma or cardiac intervention, acute native or prosthetic valve incompetence secondary to endocarditis, aortic dissection or thrombosis |
Table 2.
Variable etiology of elevated natriuretic peptide
|
Cardiac causes |
Non-cardiac causes |
|
Heart failure |
Old age |
|
Acute coronary syndrome |
Ischemic stroke |
|
Pulmonary embolism |
Subarachnoid hemorrhage |
|
Myocarditis |
Renal insufficiency |
|
Left ventricular hypertrophy |
Liver dysfunction |
|
Hypertrophic or restrictive cardiomyopathy |
Paraneoplastic syndrome |
|
Valvular heart disease |
Chronic obstructive pulmonary disease |
|
Congenital heart disease |
Severe infective disease |
|
Atrial or ventricular arrhythmia |
Severe burn |
|
Cardiac contusion |
Anemia |
|
ICD shock |
Severe metabolic or hormonal disorder (e.g. Thyroid toxicosis, diabetic ketoacidosis) |
|
Cardiac surgery |
|
|
Pulmonary hypertension |
|
Table 3.
|
Vasodilator |
Dosing |
Main side effect |
Others |
|
Nitroglycerine |
Start with 10-20 μg/min |
Hypotension, headache |
Tolerance on continuous use |
|
Increase up to 200 μg/min |
|
|
|
Isosorbide dinitrate |
Start with 1 mg/h |
Hypotension, headache |
Tolerance on continuous use |
|
Increase up to 10 mg/h |
|
|
|
Nitroprusside |
Start with 0.3 μg/kg/min |
Hypotension |
Light sensitivity |
|
Increase up to 5 μg/kg/min |
Isocyanate toxicity |
|
|
Neseritide |
Bolus 2 μg/kg+infusion 0.01 μg/kg/min |
Hypotension |
|
Table 4.
Inotropes and vasoconstrictors
|
Drug |
Bolus |
Infusion rate |
Effects |
|
Dobutamine |
No |
2-20 μg/kg/min (β) |
Increase cardiac contractility |
|
Dopamine |
No |
<3 μg/kg/min |
Renal vasodilatory effect |
|
3-5 μg/kg/min (β) |
Increase cardiac contractility |
|
>5 μg/kg/min (α) |
Vasopressor effect |
|
Milrinone |
25-75 μg/kg |
0.375-0.75 μg/kg/min |
Increase C.O. and HR |
|
Over 10-20 minutes |
|
Decrease SVR and PVR |
|
Levosimendan |
12 μg/kg |
0.1 μg/kg/min decreased to 0.05 μg/kg/min or Increase 0.2 μg/kg/min |
Increase cardiac contractility |
|
Over 10 minutes |
Vasodilatory effect via ATP dependent K channel |
|
Norepinephrine |
No |
0.2-1.0 μg/kg/min |
Vasoconstriction |
|
Epinephrine |
1 mg, i.v. repeat every 3-5 minutes during resustitation |
0.05-0.5 μg/kg/min |
Vasoconstriction |
REFERENCES
2. Thom T, Haase N, Rosamond W, Howard VJ, Rumsfeld J, Manolio T, et al. Heart disease and stroke statistics--2006 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2006;113:e85-151.   3. Fang J, Mensah GA, Croft JB, Keenan NL. Heart failure-related hospitalization in the U.S., 1979 to 2004. J Am Coll Cardiol 2008;52:428-34.   4. Youn JC, Han SW, Ryu KH. Temporal trends of hospitalized patients with heart failure in Korea. Korean Circ J 2017;47:16-24.   6. Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, Mudge GH, et al. Clinical assessment identifies hemodynamic profiles that predict outcomes in patients admitted with heart failure. J Am Coll Cardiol 2003;41:1797-804.   8. Fuat A, Murphy JJ, Hungin AP, Curry J, Mehrzad AA, Hetherington A, et al. The diagnostic accuracy and utility of a B-type natriuretic peptide test in a community population of patients with suspected heart failure. Br J Gen Pract 2006;56:327-33.   9. Yamamoto K, Burnett JC Jr, Bermudez EA, Jougasaki M, Bailey KR, Redfield MM. Clinical criteria and biochemical markers for the detection of systolic dysfunction. J Card Fail 2000;6:194-200.   10. Cowie MR, Struthers AD, Wood DA, Coats AJ, Thompson SG, Poole-Wilson PA, et al. Value of natriuretic peptides in assessment of patients with possible new heart failure in primary care. Lancet 1997;350:1349-53.   11. Krishnaswamy P, Lubien E, Clopton P, Koon J, Kazanegra R, Wanner E, et al. Utility of B-natriuretic peptide levels in identifying patients with left ventricular systolic or diastolic dysfunction. Am J Med 2001;111:274-9.   12. Kelder JC, Cramer MJ, Verweij WM, Grobbee DE, Hoes AW. Clinical utility of three B-type natriuretic peptide assays for the initial diagnostic assessment of new slow-onset heart failure. J Card Fail 2011;17:729-34.   13. Gustafsson F, Steensgaard-Hansen F, Badskjaer J, Poulsen AH, Corell P, Hildebrandt P. Diagnostic and prognostic performance of N-terminal ProBNP in primary care patients with suspected heart failure. J Card Fail 2005;11(5 Suppl):S15-20.   14. Nielsen OW, Rasmussen V, Christensen NJ, Hansen JF. Neuroendocrine testing in community patients with heart disease: plasma N-terminal proatrial natriuretic peptide predicts morbidity and mortality stronger than catecholamines and heart rate variability. Scand J Clin Lab Invest 2004;64:619-28.   15. Kelder JC, Cowie MR, McDonagh TA, Hardman SM, Grobbee DE, Cost B, et al. Quantifying the added value of BNP in suspected heart failure in general practice: an individual patient data meta-analysis. Heart 2011;97:959-63.   18. Nishikimi T, Kuwahara K, Nakao K. Current biochemistry, molecular biology, and clinical relevance of natriuretic peptides. J Cardiol 2011;57:131-40.   19. Peacock WF 4th, De Marco T, Fonarow GC, Diercks D, Wynne J, Apple FS, et al. Cardiac troponin and outcome in acute heart failure. N Engl J Med 2008;358:2117-26.   20. Januzzi JL Jr, Peacock WF, Maisel AS, Chae CU, Jesse RL, Baggish AL, et al. Measurement of the interleukin family member ST2 in patients with acute dyspnea: results from the PRIDE (Pro-Brain Natriuretic Peptide Investigation of Dyspnea in the Emergency Department) study. J Am Coll Cardiol 2007;50:607-13.   22. Cox ZL, Lenihan DJ. Loop diuretic resistance in heart failure: resistance etiology-based strategies to restoring diuretic efficacy. J Card Fail 2014;20:611-22.   25. Ezekowitz JA, Hernandez AF, Starling RC, Yancy CW, Massie B, Hill JA, et al. Standardizing care for acute decompensated heart failure in a large megatrial: the approach for the Acute Studies of Clinical Effectiveness of Nesiritide in Subjects with Decompensated Heart Failure (ASCEND-HF). Am Heart J 2009;157:219-28.   27. Pathak A, Lebrin M, Vaccaro A, Senard JM, Despas F. Pharmacology of levosimendan: inotropic, vasodilatory and cardioprotective effects. J Clin Pharm Ther 2013;38:341-9.   28. Tang X, Liu P, Li R, Jing Q, Lv J, Liu L, et al. Milrinone for the treatment of acute heart failure after acute myocardial infarction: a systematic review and meta-analysis. Basic Clin Pharmacol Toxicol 2015;117:186-94.   29. Cuffe M, Califf R, Adams K, Benza R, Bourge R, Colucci WS, et al. Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbations of Chronic Heart Failure (OPTIME-CHF) Investigators. Short-term intravenous milrinone for acute exacerbation of chronic heart failure: a randomized controlled trial. JAMA 2002;287:1541-7.   30. O’Connor C, Gattis W, Uretsky B, Adams K, McNulty S, Grossman S, et al. Continuous intravenous dobutamine is associated with an increased risk of death in patients with advanced heart failure: insights from the Flolan International Randomized Survival Trial (FIRST). Am Heart J 1999;138:78-86.   31. Clemo H, Wood M, Gilligan D, Ellenbogen K. Intravenous amiodarone for acute heart rate control in the critically ill patient with atrial tachyarrhythmias. Am J Cardiol 1998;81:594-8.   33. Konstam M, Gheorghiade M, Burnett J Jr, et al. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST outcome trial. JAMA 2007;297:1319-1331.   35. Costanzo M, Guglin M, Saltzberg M, Jessup M, Bart B, Teerlink J, et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am Coll Cardiol 2007;49:675-83.   36. Costanzo M, Saltzberg M, Jessup M, Teerlink J, Sobotka P. Ultrafiltration is associated with fewer rehospitalizations than continuous diuretic infusion in patients with decompensated heart failure: results from UNLOAD. J Card Fail 2010;16:277-84.   37. Thiele H, Zeymer U, Neumann F, Ferenc M, Olbrich H, Hausleiter J, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012;367:1287-96.   38. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Hausleiter J, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12 month results of a randomised, open-label trial. Lancet 2013;382:1638-45.   39. Bartlett RH, Roloff DW, Custer JR, Younger JG, Hirschl RB. Extracorporeal life support: the University of Michigan experience. JAMA 2000;283:904-8.   40. Chen YS, Chao A, Yu HY, et al. Analysis and results of prolonged resuscitation in cardiac arrest patients rescued by extracorporeal membrane oxygenation. J Am Coll Cardiol 2003;41:197-203.   42. O’Neill WW, Kleiman NS, Moses J, Henriques JP, Dixon S, Massaro J, et al. A prospective, randomized clinical trial of hemodynamic support with impella 2.5 versus intra-aortic balloon pump in patients undergoing high-risk percutaneous coronary intervention: the PROTECT II study. Circulation 2012;126:1717-27.   43. Youn YJ, Yoo BS, Lee JW, Kim JY, Han SW, Jeon ES, et al. Treatment performance measures affect clinical outcomes in patients with acute systolic heart failure: report from the Korean Heart Failure Registry. Circ J 2012;76:1151-8.  
|
|







