중환자실 환자의 통증조절과 진정요법
Management of Pain and Agitation for Patients in the Intensive Care Unit
Article information
Trans Abstract
Patients admitted to the intensive care unit (ICU) commonly develop pain and agitation. Such symptoms are associated with adverse clinical outcomes, as they can cause delirium, self-removal of life-sustaining devices, difficulty in use of ventilatory supports, hemodynamic instability, intracranial hypertension, posttraumatic stress disorder, etc. Thus, prompt recognition and treatment of pain and agitation are imperative. Identification of possible causes of pain and agitation and nonpharmacological managements should be attempted initially. However, administration of analgesics and sedatives is necessary in many cases. Preemptive interventions prior to procedures to relieve pain are recommended. Intravenous opioids are considered as the first-line drug to treat pain in critically ill patients, especially in those who require mechanical ventilation. For most patients in the ICU, a light level of sedation is associated with improved clinical outcomes. However, patients with unstable medical conditions including severe acute respiratory distress syndrome, hemodynamic instability, refractory status epilepticus, and intracranial hypertension may require a deep level of sedation. Sedation strategies using non-benzodiazepine sedatives may be preferred over sedation with benzodiazepines in mechanically ventilated patients to shorten the duration of mechanical ventilation, length of ICU stay, and days with delirium. Often, ensuring that critically ill patients are free from pain and agitation may conflict with other clinical management goals. Therefore, provision of comprehensive care based on the patients’ condition cannot be overemphasized in the ICU. The purpose of this review is to address pain and agitation management strategies and introduce pharmacological characteristics of sedatives and analgesics commonly used in the ICU.
서 론
수많은 중환자실 환자들은 질환, 외상, 시술, 수술 등으로 통증을 느낀다. 하지만,의식 장애, 마비, 기관 삽관 등으로 인하여 자신의 통증을 의료진에게 제대로 표현하지 못하는 경우가 흔하다. 설령 환자가 통증을 호소하더라도 의료진에 의해 적절하게 조절되지 못하는 경우도 드물지 않다. 따라서, 통증은 중환자에게 참기 힘든 심적 육체적 고통을 유발한다. 이로 인하여 섬망, 혈역학적 불안정, 조직손상, 스트레스심근병증 등이 초래될 수 있고, 심지어 퇴원 후 외상후스트레스증후군(posttraumatic stress disorder)이 발생하기도 한다. 즉, 통증은 중환자에서 매우 흔하며, 심각한 정신적 신체적 스트레스가 되고, 불량한 예후와 관련되므로 수시로 평가되고 적절하게 조절되어야 한다. 초조(agitation)와 흥분(irritability)도 중환자에서 자주 관찰되며 환자의 나쁜 예후와 관련 있다[1]. 이러한 증상이 적절하게 조절되지 않을 경우 환자에 의한 생명유지장치의 제거, 기계환기 장애, 혈역학적 불안정, 뇌압 상승 등의 문제가 발생할 수 있다. 따라서, 중환자가 초조하고 흥분한 경우, 즉각 원인을 파악하여 해결해야 한다. 이를 위해 비약물적 처치를 우선적으로 시행하는 것이 바람직하다. 하지만, 많은 경우에 있어서 결국 진정제(sedative) 처방이 필요하다.
저자들은 본 종설에서 중환자실 환자의 통증조절(진통)과 진정요법에 대한 일반적인 원칙을 설명하고 진통제와 진정제의 약리학적 주요 특성을 소개하고자 한다. 중환자의 초조 ⋅ 통증에 대한 평가와 섬망에 대한 평가 ⋅ 치료는 본 학회지 이번 호의 다른 논문을 참고하기 바란다.
본 론
통증조절과 진정을 위한 치료 전략
통증은 실제적이거나 잠재적인 조직손상과 관련된 불쾌한 감각과 감정적 경험을 말한다[2]. 중환자가 통증을 느끼는 경우는 매우 흔하다. 질병, 외상, 화상, 수술뿐만 아니라 중환자실에서 행해지는 각종 시술도 통증의 원인이 된다. 통증은 매우 주관적이기 때문에 환자가 직접 호소하지 않으면 이를 다른 사람이 파악하기 힘들다. 하지만, 중환자는 의식변화, 기계 환기, 진정제, 근이완제 등으로 자신의 통증을 적절하게 표현하지 못하는 경우가 많다. 따라서, 환자의 통증 유무와 정도를 파악하기 위한 의료진의 노력이 필요하며, 이를 위해 평가 도구를 활용하는 것이 도움이 된다. 의사표현을 할 수 있는 환자에게는 수치평가척도(numerical rating scale)가 흔히 사용되고, 의사표현 능력이 없는 환자에게는 Behavioral Pain Scale 와 Critical-Care Pain Observation Tool이 많이 사용되는 통증 평가도구이다. 통증을 평가한 후에는 이를 적절하게 조절해야 한다. 통증에 의해 카테콜아민 분비, 교감신경 항진, 분해대사(catabolism)로 인한 조직 손상이 초래되고, 인공호흡기 등의 각종 장치 유지가 힘들어지고, 환자는 불안 초조해지게 된다[3]. 결국, 통증은 중환자에게 커다란 정신적 육체적 스트레스가 되며, 심지어 퇴원 후 발생하는 외상후증후군의 원인으로 작용하기도 한다. 따라서, 중환자의 통증은 수시로 평가되고 적절하게 조절되어야 한다.
중환자가 초조하고 흥분하는 증세를 보일 경우, 우선 그 원인을 찾아 보아야 한다. 통증, 호흡 부전, 인공호흡 불편감, 약물 금단증상과 부작용, 대사장애, 전해질장애, 내분비장애 등이 초조와 흥분의 흔한 원인이다. 이후 비약물적 처치를 우선 고려해야 한다. 하지만, 결국 진정제 투여가 필요한 경우가 많다. 진정제를 처방할 때에는 얕은 진정(light sedation)을 목표로 할 지 아니면 깊은 진정(deep sedation)을 목표로 할 지 먼저 결정해야 한다. 대부분의 경우 얕은 진정을 목표로 하는 것이 바람직하다. 이러한 전략은 불필요한 약물 사용과 그에 따른 부작용을 줄이면서도 목표로 하는 수준의 진정 상태를 유지하는데 도움이 된다. 실제로, 깊은 진정을 유도하는 것에 비해 얕은 진정을 유도하는 것은 인공호흡기 적용 시간 감소, 중환자실과 병원 입원 기간 감소, 섬망 발생 감소와 관련 있다[3,4]. Richmond Agitation-Sedation Scale을 사용할 경우에는 얕은 진정의 목표로 0점 내지 -2점을 정하면 된다. 반면, 깊은 진정이 필요한 경우도 있다. 혈역학적 불안정, 심한 저산소증, 뇌압상승, 혼수요법 등이 그 대표적인 예이다. 혈역학적으로 불안정한 저산소증 환자에게 진정제 투여를 통해 조직의 산소소모를 줄이고 인공호흡기 적용을 원활하게 할 수 있고, 뇌압이 상승한 경우에는 충분한 진정제 투여만으로도 뇌압 감소 효과를 기대할 수 있으며, 불응뇌전증지속상태(refractory status epilepticus)에서는 실시간 뇌파검사를 병행하면서 돌발파억제(burst-suppression)를 유도하는 것이 경련 조절을 위해 필요할 수 있다. 이렇게 깊은 진정을 목표로 할 때에는 Richmond Agitation-Sedation Scale 점수 -3 내지 -5점을 유지하면 된다. 적절한 진정요법을 위해서는 진정 깊이에 대한 목표를 미리 세우고, 평가지표를 활용하여 수시로 진정수준을 확인하고, 이에 따라 진정제의 종류와 용량을 조절하는 방식의 체계적인 진정 전략이 도움이 된다.
중환자에게 처방할 진통제와 진정제를 선택함에 있어서 환자의 전신 상태, 약 처방이 필요한 이유, 진통 진정의 목표 수준, 약물의 특성과 부작용, 약제 비용 등을 고려하게 된다. 일반적으로 중환자의 비신경병통증을 조절하기 위한 진통제 선택에 있어서 1차 약제로 추천되는 것은 아편유사제(opioid) 정맥 주입이다. 여기에 아세트아미노펜(acetaminophen, paracetamol), 비스테로이드소염제(nonsteroidal anti-inflammatory agents), ketamine 등의 비마약성(nonopioid) 진통제를 병용하면 아편유사제의 처방 양을 감소시키고 그 부작용을 줄이는 효과가 있다. 신경병성 통증에 대해서는 gabapentin, pregabalin, 카바마제핀(carbamazepine) 등이 효과적이다. 복부대동맥 수술 후 발생하는 통증에는 가슴경막외마취(thoracic epidural anesthesia/analgesia)도 추천되는 방법이다. 이러한 방법은 외상성 늑골 골절에 의한 통증 치료에도 효과적이다. 인공호흡기를 적용하는 환자의 진정제로는 미다졸람(midazolam)이나 lorazepam 등의 벤조디아제핀(benzodiazepine)보다는 propofol이나 dexmedetomidine 등의 nonbenzodiazepine를 추천할 수 있다[3,5,6]. 중환자에서 벤조디아제핀을 진정제로 선택할 경우 섬망 발생 빈도, 인공호흡기 적용 일수, 중환자실 재원 일수가 증가하는 것으로 알려져 있다[3]. 하지만, 알코올 금단, 벤조디아제핀 금단, 진전섬망, 경련, 불안 등을 조절하기 위한 목적으로 진정제를 처방할 경우에는 벤조디아제핀을 우선적으로 고려할 필요가 있다.
통증조절과 진정에 관한 신경계 중환자의 특수성
신경계 중환자의 진통과 진정에 대해 몇 가지 추가 고려 사항이 있다. 첫째, 진통제와 진정제는 뇌압 등의 뇌신경생리에 변화를 초래한다. 초조와 통증은 뇌압(intracranial pressure), 뇌관류압(cerebral perfusion pressure), 뇌혈류량(cerebral blood flow)에 변화를 줄 수 있다. 초조와 통증이 발생한 경우에 뇌압이 상승할 수 있다. 혈압이 일정할 때 뇌압이 상승하면 뇌관류압이 감소하고, 이로 인해 뇌혈류량이 감소할 수 있다[7]. 따라서, 신경계 중환자에게 진정제 진통제를 처방할 때에는 약제가 뇌혈관에 미치는 영향도 고려해야 한다. 이를 통해 뇌압을 적절하게 조절하고 뇌손상의 이차 발생을 최소화할 수 있다[7]. 이 때문에 신경계 중환자는 뇌압 상승을 조절하기 위해 깊은 수준으로 환자를 진정시켜야 하는 경우가 드물지 않다. 둘째, 진정제와 진통제를 갑자기 중단할 때 환자의 뇌에 미치는 영향이 있다. 일반 중환자실에서는 인공호흡기를 적용한 환자에게 저산소증이나 혈역학적불안정 등의 문제가 해결되면 매일 진정제를 중단함으로써 환자의 각성을 유도하고(spontaneous awakening trial) 환자 스스로 호흡을 할 수 있는지 평가하게 된다(spontaneous breathing trial). 신경계 중환자의 경우 진정제를 중단한 상태에서 신경학적진찰을 위해 지속 주입하던 진정제를 갑자기 중단해야 하는 경우가 많다(wake-up test). 이를 통해 환자의 신경학적 상태의 변화를 관찰할 수 있다. 하지만, 뇌손상이 심한 환자에게 이러한 방법을 적용할 경우 뇌압상승, 뇌산소분압저하, 뇌대사장애(cerebral metabolic distress) 등이 발생할 수 있으므로 주의가 필요하다. 게다가, 약물을 중단한 후 환자가 의식을 회복하기까지 오랜 시간이 소요된다면 신경학적 평가를 하는데 있어서 많은 제약이 있다. 따라서, 신경계 중환자에게 이상적인 진정제는 신속하게 진정 효과를 나타내고, 투여를 중단하면 빠르고 확실하게 효과가 사라지는 약제일 것이다. 이를 위해서는, 환자의 상태를 고려하여 속효성 약제를 간헐적 약덩이(bolus)로 투여하거나 반감기가 짧은 약제를 정맥 내로 지속 주입하는 것이 유리하다[8]. 물론, 약제 독성을 피하기 위해 치료지수(therapeutic index)가 큰(즉, 유효농도와 독성농도 사이의 폭이 넓은) 약제가 선호된다[9]. 셋째, 경련이 동반되거나 경련 역치가 낮은 환자에 대한 고려가 필요하다. 이러한 환자에게는 항경련효과가 있는 propofol이나 벤조디아제핀을 선택하는 것이 적절할 것이다. 경련 위험이 높은 환자에게 뇌파 모니터링을 하지 않는 상태에서 경련 유발 가능성이 있는 진정제나 진통제를 처방하거나 심지어 근이완제를 처방하는 것은 조심해야 한다. 넷째, 신경계 중환자는 의식변화, 언어장애, 사지마비 등으로 적절한 의사 소통이 힘든 경우가 많다. 의사표현이 힘든 경우에는 앞서 언급한 평가지표를 활용하는 것도 진통 ⋅ 진정 목표 도달에 도움이 된다. 마지막으로, 중증근무력증이나 길랑-바레증후군처럼 의식, 호흡중추, 폐, 심장 이상이 없이 기도유지와 호흡근력 감소 때문에 인공호흡기를 weaning mode로 장기간 적용해야 하는 경우가 있다. 이때 대부분 얕은 진정 만으로도 충분하다. 이 경우, 저자의 경험으로는 호흡억제 가능성이 낮고 침분비억제 효과가 있는 dexmedetomidine이 유용하다. 이렇듯, 신경계 중환자는 중환자의 일반적인 특성에 더불어 신경계 손상에 따른 특수 상황을 고려하여 진정제와 진통제를 선택할 필요가 있다.
통증조절과 진정을 위한 비약물적 치료
중환자의 통증과 초조 증상을 조절하기 위하여 다양한 비약물적 처치를 적용해 볼 수 있다. 비약물적 처치로서 일반적으로 추천되는 방법은 다음과 같다. 첫째, 환자에게 편안한 환경을 제공해 주어야 한다. 중환자실의 소음과 지나치게 밝은 조명은 환자의 교감신경을 자극하여 아드레날린 분비를 증가시킴으로써 불안과 흥분을 높이고 수면을 방해하고 통증 내성을 감소시켜 환자의 통증을 악화시킬 수 있다[10]. 소음 감소를 위해 환자 모니터와 인공호흡기 등 의료장비의 알람을 완화하여 설정하거나, 환자 침상 가까이에서 대화 소리를 줄이는 방법, 귀마개를 제공하는 방법, 다른 소리로 소음의 효과를 최소화하는 음향 차폐 등을 이용할 수 있다. 수면 증진을 위한 조명 관리를 위해서는 낮에는 자연광이나 형광등 불빛이 들게 하고, 밤에는 중환자실 전체를 어둡게 조광을 조절하거나 환자에게 안대를 제공하는 방법이 도움이 된다[1]. 이외에도 최적의 인공호흡기 조화 상태를 유지시키고, 환자 치료 활동 그룹을 만들어 같은 시간에 함께 적용하는 것이 유용하다[11]. 둘째, 환자의 불편함을 파악하여 적극적으로 해결해 주어야 한다. 체위 변경과 같은 신체적 요구와 안위 요구의 충족, 방광 팽만의 완화, 변비, 피부 상태 등을 수시로 사정하여 해결해 주어야 한다. 또한 불편감을 유발하는 카테터나 관은 최대한 빨리 제거한다. 광선공포증, 복시, 안진 등에 대해 눈가리개를 적용해 주는 것도 도움이 된다. 마비된 사지의 수동적 관절운동, 마비된 팔에 지지대 적용, 머리 붕대를 느슨하게 적용하는 것도 환자의 불편감 해소에 도움이 된다[12]. 셋째, 환자의 불안감을 덜어 주어야 한다. 환자에게 질병의 상태, 치료 계획, 치료 장치, 익숙하지 않은 소리, 경고음의 의미에 대해 설명해 주는 것은 환자의 불안 해소에 도움이 된다. 계획된 시술과 처치에 대한 정보를 미리 제공하여 환자가 정신적으로 준비할 수 있게 해줄 필요도 있다[13]. 환자에 따라 억제대 사용이 필요할 수 있는데, 억제대 유지의 필요성을 지속적으로 재평가해야 한다[14]. 넷째, 주의전환법도 도움이 된다. 이는 환자가 선택한 음악을 듣게 해 주거나, 불편한 시술 중에 환자와 담소를 나누거나, TV를 시청하도록 해 주는 등 환자의 관심을 통증이나 불안감을 초래하는 것으로부터 유쾌한 무엇인가로 향하도록 돌려놓게 하는 방법이다. 마사지나 문지르기와 같은 신체 접촉은 말초에서 척수 섬유를 따라 전달되는 통증 자극을 차단하는 역할을 함으로써 통증을 경감시키는데 기여할 수 있다. 말초에 적용하는 온요법은 국소적 혈관 이완을 통해 순환을 증진함으로써 통증 매개물질의 제거를 촉진하고, 냉요법은 통증으로 유발되는 화학물의 분비를 감소시켜 통증 경감 효과를 가져 온다[15]. 환자의 흥분에 대해 성급하게 진정제를 처방하기에 앞서 환자의 불편감과 그 원인을 파악하고 이를 해결해 주기 위한 비약물적 처치가 선행되어야 한다. 이를 통해 불필요한 약 처방과 그에 따른 부작용의 발생 위험을 줄일 수 있다.
진통제와 진정제 처방 시 고려할 점
1) 진정제와 진통제가 전신 및 뇌에 미치는 생리적 영향
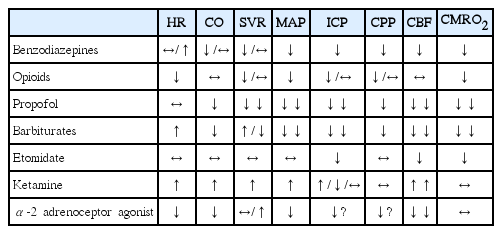
진정제와 진통제 투여는 신체 전반과 뇌의 생리에 있어서 많은 영향을 미친다. 따라서, 약물처방에 앞서 약물이 생리작용에 어떠한 영향을 미치는지 잘 알고 있어야 한다. Table 1은 각각의 약제들이 전신 및 뇌에 미치는 생리적 영향을 대략적으로 나타낸 표이다[9]. 이 표에서 제시한 약물의 효과를 예측함에 있어서 환자 개개인의 특성도 반드시 고려되어야 한다. 이를테면, 환자가 통증으로 인해 뇌압이 증가된 경우라면 아편유사제 투여로 인해 진통과 뇌압 감소 효과를 기대할 수 있다. 하지만, 이미 충분히 진정되고 통증이 없는 상태라면 아편유사제 추가 처방으로 뇌압이 더 감소할 것을 기대하기는 어렵다. 만약 아편유사제 투여로 인하여 호흡이 억제되어 동맥 내 이산화탄소 분압이 증가한다면 뇌혈관 확장으로 인하여 오히려 뇌압은 증가할 것이다. 따라서, 약물에 의한 뇌에 미치는 생리변화는 환자의 특성에 따라 다양할 수 있다.
2) 동반 질환과 장기 부전에 의한 영향
중환자는 기존 질환, 패혈증, 쇼크, 감염, 외상, 약물 부작용 등으로 신기능과 간기능이 저하된 경우가 많다. 따라서, 간으로 대사되거나 신장으로 배설되는 약물을 처방할 때에는 주의가 요구된다. 신장으로 배설되는 약물을 신기능 저하 환자에게 투여하면 신체 내 약물 축적으로 약효가 연장될 수 있다. 따라서, 이 경우 약의 용량을 줄이거나 투여간격을 늘리는 방식으로 조절할 필요가 있다. 특히 활성대사물(active metabolite)이 발생하는 약물의 경우, 약효 지속시간이 더 길어질 수 있다. 간부전 환자에서도 약물의 대사가 변할 수 있으며, 혈역학적으로 불안정할 때 간과 신장에 도달하는 혈류량이 변하여 약물의 분포가 달라질 수 있다. 따라서, 이러한 환자들에게 진정제와 진통제를 처방할 때에는 동반된 신기능과 간기능을 고려하여 약제를 선택하고 용량을 조정해야 한다.
소화기 질환이 있는 경우 약물 흡수에 지장이 있어 정맥 투여가 선호될 수 있다.위장관을 통한 흡수에는 지장이 없지만 의식저하나 삼킴장애 때문에 비위관을 통해 약물을 투여할 경우에도 몇 가지 주의가 필요하다. 이 경우 경장영양을 병행하는 경우가 많은데, 경장영양에 포함된 영양성분과 경구 약물 성분의 상호작용으로 인해 영양성분의 불활성화가 일어나거나 약효가 증가 또는 감소할 수 있다. 일반적으로, 일부 약물의 경우 경장영양관 내에 침착되거나 관을 막아서 약효를 떨어뜨리거나 약물의 흡수가 저하될 수도 있다. 이러한 경우, 약물 투여를 중단하거나 약물 제형을 변경하는 것이 필요하다. 하지만, 진정제와 진통제 중에 이러한 점이 문제되는 약제는 별로 없는 것 같다. 경장영양 환자에서는 액제, 구강붕해정, 속효성 정제 등이 추천된다. 지속형 제제나 장용성 제제는 파우더로 투여하지 않도록 한다. 경장 영양관으로 약물을 주입하는 경우 시럽제제로 투여하는 것이 좋다. 정제는 파우더로 투여하고 캡슐 제재는 개봉하여 투여하되, 최소 30 mL 이상의 물에 녹여 투여한다. 또한, 영양성분과 약물의 상호작용을 피하기 위해 약물 투여 시 일시적으로 경장영양 투여를 중단해야 하고 약물 투여 전후로 관 세척을 시행한다. 여러 개의 약물을 투여할 때에는 가급적 각각의 약을 따로 투여하는 것이 바람직하다. Nasoduodenal 또는 nasojejunal tube로 약물을 투여할 경우 nasogastric tube로 약물을 투여할 때와 비교하여 약물 역동학에 변화가 있을 수 있지만 진정제나 진통제 중에 이러한 점이 문제되는 약제는 특별히 없는 것 같다.
3) Context-sensitive half-time
Context-sensitive half-time은 약물의 지속 주입이 중단된 후 약물의 혈장 농도가 50%로 감소하는데 걸리는 시간이다. 여기서 ‘context’는 지속 주입된 시간을 의미한다. 중환자실에서 지속주입하는 진통제와 진정제의 약물 반감기를 고려할 때에는 context-sensitive half-time으로 평가해야 한다. Fig. 1은 국내 신경계 중환자실에서 비교적 흔히 사용되는 진통제와 진정제의 context-sensitive half-time을 나타낸 그래프이다[16-18]. Fentanyl의 경우 지속 주입 시간이 길어질수록 context-sensitive half-time이 급격히 증가한다. 이는 fentanyl의 친지방성 재분포(lipophilic redistribution), 즉 central compartment로부터 근육이나 지방 조직으로 재분포하는 현상에 의한 것으로 생각된다. 따라서, fentanyl을 장기적으로 지속 주입할 경우, 약물 주입 중단 후에도 약의 효과가 소진되기까지 많은 시간이 걸릴 수 있음을 이해해야 하겠다. 반면, remifentanil은 비교적 context-insensitive 한 약물이므로 여러 날 지속 주입한 후 중단하더라도 약의 반감기가 더 길어지지 않는다. 이런 측면에서 보자면, 신경계 중환자실에서 진통제를 중단하고 즉시 신경학적진찰을 시행해야 하는 경우가 빈번하다면 fentanyl 보다는 remifentanil을 선택하는 편이 더 유리하다[19]. 하지만, 아편유사제를 자주 중단할 필요가 없다면, 가격적인 측면도 고려하여 약제를 선택할 필요가 있다.
4) 저체온 상태에서 약물 대사의 변화
저산소허혈뇌병증 환자의 뇌신경 보호를 위해서 또는 뇌졸중 등의 뇌손상에 의한 뇌부종을 치료하기 위해 저체온 상태를 유도하는 경우가 점차 증가하고 있다. 하지만, 이러한 체온조절요법(targeted temperature management, TTM)을 시행하는 동안 약물의 흡수, 대사, 배설에 변화가 발생한다. TTM 적용 48시간 내에 나타나는 대표적인 약물 대사 변화로는 cytochromes P450 (CYPs) 활성도 저하를 들 수 있다. 저체온 상태에서 CYPs을 통한 약물의 대사와 배설이 감소되므로 약효가 증강된다. 이 때문에 TTM을 시도할 때에는 약물 독성을 감시해야 하고 필요 시 약물 용량을 감량해야 한다. CYPs을 통한 배출 경로(elimination pathway)를 갖는 약제로는 propofol (CYP2B6), 미다졸람 (CYP3A4), alprazolam (CYP3A4), 모르핀(morphine) (CYP2D6), fentanyl (CYP3A4), dexmedetomidine (CYP2A6), buspirone (CYP3A4) 등이 있다. Remifentanil은 CYPs을 거치지 않는다. 저체온 상태에서 이러한 약물들의 배설이 감소하고 혈중농도가 증가하는 현상이 보고된 바 있다[20]. 반면, 저체온 요법은 약물의 역가(potency)와 효능(efficacy)을 감소시킬 수도 있다. 한 동물 연구에서는 30 ℃ 상태에서 µ-수용체친화성(µ-receptor affinity) 저하로 모르핀의 역가가 감소했다[21]. 따라서, TTM을 시행할 때에는 체온에 따른 약물 대사 변화를 이해하고, 약의 효과와 부작용이 정상 체온 상태와는 다를 수 있음을 고려해야 한다.
5) 경련과의 관련성
경련을 유발할 수 있는 것으로 보고된 진정제와 진통제로는 fentanyl, meperidine, tramadol, ketamine, mefenamic acid 등이 있다[22]. 벤조디아제핀 계열의 해독제로 쓰이는 flumazenil도 경련을 일으킬 수 있다. 또한 벤조디아제핀과 같은 약물을 갑자기 중단할 경우, 금단현상의 하나로 경련이 유발될 수도 있다[22,23]. 따라서, 이전에 경련을 경험한 환자나 경련의 역치를 저하시킬 수 있는 약제를 투여하고 있는 환자에서는 진정제 진통제 처방에 유의해야 하며, 약물의 투여시작 시점이나 용량 변경시 부작용을 주의 깊게 감시해야 한다.
6) 약물상호작용
두 가지 이상의 중추신경억제제(central nervous system depressant)를 병용 투여하는 경우 추가적인 중추신경억제작용이 유발되고, 호흡억제, 저혈압, 깊은 진정 효과 또는 혼수가 나타날 수 있다. 이러한 경우, 약물의 용량을 감량하는 등 약 조정이 필요하다. 또한, 마약성 진통제와 모노아민산화효소억제제(monoamine oxidase inhibitor, MAO-I)를 병용 투여할 때에는 고혈압을 동반한 중추신경 흥분 또는 저혈압을 특징으로 하는 중추신경억제를 일으킬 수 있다[24]. 따라서, MAO-I 투여 중이거나 투여 중단 후 2주 이내의 환자는 마약성 진통제 투여의 금기가 된다. Tramadol의 경우도 MAO-I와 병용 투여 시 경련 위험이 증가한다. 중환자에게 흔히 처방되는 amiodarone, ciprofloxacin, azole계 항진균제(fluconazole, itraconazole, voriconazole)는 CYP3A4 억제제이므로 fentanyl, 디아제팜(diazepam), 미다졸람, alprazolam, tramadol의 대사를 억제하여 혈중농도를 높일 수 있다. 또한 중환자의 해열 진통 목적으로 자주 처방되는 아세트아미노펜은 rifampin에 의해 진통 효과가 감소될 수 있고 바비튜르산염(barbiturates), 카바마제핀, 페니토인(phenytoin)에 의해 간 독성 위험이 증가한다.
7) 금단증상
중환자 진료 시 환자 개개인의 상태를 감안하여 진정제 투여가 필요한지 매일 재평가하고 약물 용량도 재조정해야 한다. 질병의 상태가 호전을 보이고 진정제 투여의 필요성이 낮아지면 진정제와 진통제를 감량하거나 중단해 보아야 한다. 하지만, 진정제와 진통제에 장기간 노출된 환자들은 약물 의존성이 생길 수 있고, 갑자기 중지하면 금단증상(withdrawl syndrome)이 발생할 수 있다. 아편유사제 금단증상으로는 초조, 불안, 혼돈, 콧물, 눈물, 발한, 산동, 털세움(piloerection), 복통, 설사, 경련, 구역, 구토, 빈맥, 고혈압, 열 등이 있다. 벤조디아제핀 금단증상으로는 불안, 혼돈, 흥분, 떨림, 빈맥, 고혈압, 경련, 열 등이 있다. 이와 같은 약제들을 1주일 이상 지속 정주하거나 고용량으로 투여한 경우 금단증상이 발생할 가능성이 높으므로 체계적으로 감량 후 중단해야 한다. 특히, 여러가지의 진정제와 진통제를 투여한 경우에는 일반적으로 아편유사제를 가장 마지막에 감량하는 것이 필요하다. 아편유사제 지속 주입 후 금단증상을 예방하기 위한 전략으로는 용량을 서서히 감량하면서 장시간 작용 경구 제제(예: oxycodone)나 아편유사제 부착포(opioid patch)로 변경하거나, dexmedetomidine을 추가하는 것이 도움이 될 수 있다[25]. 진정제와 진통제의 금단증상이 예상되거나 관찰될 경우에는 천천히 감량 후 중단하는 전략이 필요하다.
진정제 및 진통제 각론
1) 진통제
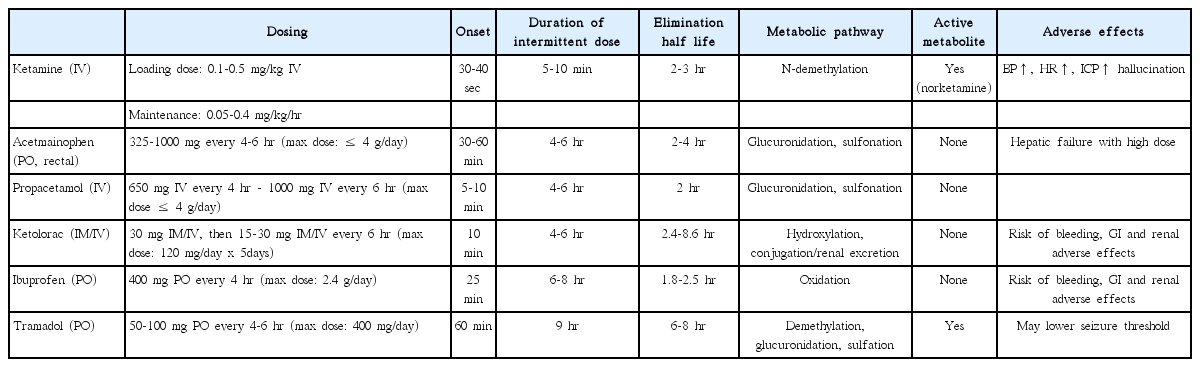
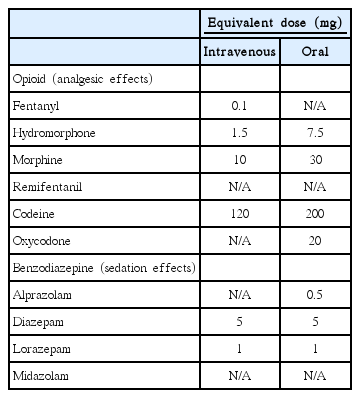
중환자실에서 빈번하게 처방되는 진통제로는 아편유사제(모르핀, hydromorphone, fentanyl, remifentanil), ketamine, 아세트아미노펜, 비스테로이드소염제(ibuprofen, ketorolac), tramadol 등이 있다. Table 2과 Table 3에서 아편유사제와 비마약성진통제 종류별로 투여용량, 약동학적 특징, 부작용, 주의 사항 등을 요약하였다[3,12,26,27]. Table 4는 아편유사제 종류별로 역가를 대략적으로 정리한 표이다.
(1) 아편유사진통제(opioid analgesics)
아편유사진통제(아편유사제)는 중환자의 급성 통증에 대해 가장 빈번하게 사용되는 진통제로서 모르핀, hydromorphone, fentanyl, remifentanil 등이 있다. 이 중, 모르핀은 작용지속시간이 길고, 호흡과 기침을 강력하게 억제하는 작용을 가진다. 모르핀 투여 시 히스타민 분비가 증가하여 혈관 확장, 혈압 저하, 장 운동 저하가 나타날 수 있다. 모르핀의 활성대사물(active metabolites) 때문에 신부전 환자에서 진정 기간이 길어질 수 있다. Fentanyl은 모르핀에 비해 100배 더 강력한 진통 효과를 가지는 약제이다. 이는 강한 친지방성 물질이므로 작용 발현 시간이 빠르며, 반복 투여 시 약물이 체내에 축적되어 작용 시간이 연장될 수 있다. Fentanyl은 모르핀과 달리 히스타민을 유리하지 않기 때문에 부작용인 저혈압을 덜 초래한다. 하지만, 고용량의 부하용량을 빠르게 주입하면 혈압 저하가 발생할 수 있다. 특히, 기관 삽관 시에 fentanyl을 부하용량으로 주입하는 경우가 많은데 1분 이상에 걸쳐 천천히 주입하면 저혈압 부작용이 덜 생긴다. 고용량 투여시 흉곽 굳음(chest wall rigidity) 부작용도 나타날 수 있다. 또한 Fentanyl은 피부부착포(transdermal patch)의 형태로 투여될 수도 있다. 피부부착포는 일정하게 약물을 유리하지만, 투과성, 온도, 조직관류, 피부 두께 등에 의해 흡수 정도가 다를 수 있고 혈장 내 최고 농도는 환자 마다 차이가 크기 때문에 주의가 필요하다. Fentanyl 피부부착포의 최고 효과가 나타날 때까지는 12-24 시간이 소요되므로 급성 진통을 필요로 하는 경우에는 추천되지 않는다. Remifentanil은 초속효성 진통제이다. 빠른 작용 발현과 매우 짧은 작용지속시간 때문에 약물 주입을 중단하고 신경학적진찰을 자주 평가해야 하는 상황에서 특히 유용한 약제이다. 활성대사물을 만들지 않고, 혈장 에스터분해효소(plasma esterase)에 의해 비활성대사물로 금방 분해되기 때문에 간부전이나 신부전 환자에서도 체내 축적되지 않는 장점이 있다. 따라서, 다장기 부전이 있는 환자에서도 fentanyl 보다 유리한 약리학적 특성을 가진다. Hydromorphone의 작용지속시간은 모르핀과 비슷하지만 활성대사물이 생성되지 않는다. 모르핀과 hydromorphine은 CYPs 대사를 거치지 않기 때문에, fentanyl과 달리 CYP3A4 대사를 변경시키는 약제와 상호작용이 없다. Meperidine은 작용시간이 짧을 뿐만 아니라, 활성대사물이 중추신경계에 축적되어 중추신경 자극을 유발할 수 있는 것으로 알려져 있다. 이 때문에 신경계 중환자실에서 이 약제를 활용하는 것을 추천하기는 힘들지만, 오한 조절에는 특히 효과적이다[15]. 코데인(codeine)은 역가가 약해서 신경계 중환자실에서의 사용은 제한적인 편이다. 하지만, 기침이 심한 환자에게 진해 목적으로 유용하게 처방될 수 있다. 아편유사제의 일반적인 부작용으로는 호흡 억제, 혈류역학적 부작용(저혈압), 중추신경계 부작용(의식수준 저하, 환각, 격앙 등), 위장관계 부작용(장 운동 저하) 등이 있다. 아편유사제의 부작용을 역전시키기 위해서 경쟁적 길항제인 날록손(naloxone)을 투여하지만, 장기간 아편유사제를 투여한 경우 금단증상을 유발할 수 있기 때문에 각별한 주의가 필요하다. 약덩이로 정맥 주입할 경우 0.04 - 0.4 mg를 투여하고, 반감기가 긴 아편유사제에 대해서는 0.2 - 0.6 mg/hr 속도로 지속 주입이 필요할 수도 있다. 아편유사제는 강력한 진통작용과 진정작용을 가지는 약제이다. 이러한 약물의 특성과 부작용을 잘 알고 있으면 인공호흡기를 적용하는 환자나 통증이 있는 환자에게 유용하게 쓸 수 있다.
(2) Ketamine
Ketamine은 모르핀만큼 강력한 진통작용이 있으면서, 호흡억제가 적고 기관지 확장 효과가 있다. 아편유사제와 달리 ketamine은 교감신경계 활성화를 통해 혈압과 심박수를 증가시키고 장 운동을 감소시키지 않는 특성이 있다. 따라서, 천식 등 기관지 수축이 동반된 환자나 저혈압이나 빈맥으로 인해 혈역학적으로 불안정한 환자에게 유용하다. 하지만 혈압 상승과 심근 산소 소모 증가 작용 때문에 관상동맥질환, 심부전, 치료되지 않은 동맥류가 있는 환자에서는 사용을 추천하기 힘들다. Ketamine이 뇌압을 증가시키는가에 대해서는 논란이 있다. Ketamine 투여 후 발생한 뇌압상승 보고로 인해 뇌압이 증가된 환자에게 ketamine 투여는 금기라는 인식이 예전에 있었지만, 최근 연구에서는 ketamine이 뇌압을 증가시킨다는 증거를 찾기 힘들며 오히려 뇌압을 감소시킨다는 보고가 있다[28,29]. 이는 이전 단락에서 언급한 바대로 동일한 약제를 투여하더라도 환자의 전신 상태나 혈압에 따라 뇌압에 미치는 효과가 다를 수 있기 때문으로 해석할 수 있겠다. 또한 ketamine은 N-methyl-D-aspartate (NMDA) 수용체 길항제로 작용하기 때문에 뇌전증지속상태에서 벤조디아제핀 계열의 약제로 경련이 조절되지 않을 때 투여하면 효과적으로 경련을 조절할 수 있다[30]. 부작용으로는 환각, 섬망, 불쾌감, 과다침분비, 구역, 구토 등이 있다. 신부전이나 간부전 환자에서 활성대사물인 norketamine이 축적될 수 있다. 예전에는 뇌압증가의 가능성이 보고되어 신경계 중환자실에서 ketamine이 별로 사용되지 않았다. 하지만, 문헌보고와 저자의 경험으로는, 환자의 신경학적 상태, 전신상태, 약의 특성을 잘 알고 처방한다면 ketamine이 뇌압에 부정적인 영향을 미치지 않기 때문에 유용하게 잘 활용할 수 있는 약제이다.
(3) 비스테로이드소염제
비스테로이드소염제는 효능이 약한 진통제이며, 대표적인 약제로는 ketorolac과 ibuprofen이 있다. 하지만, 통증이 지속적이고 심한 양상이 아니라면 간헐적으로 발생하는 급성 통증을 조절하기 위해 유용하게 사용할 수 있다. 비스테로이드소염제는 염증반응에서 중요한 효소인 고리산소화효소(cyclo-oxygenase, COX)를 비선택적, 경쟁적으로 억제함으로써 진통효과를 나타내며, 아편유사진통제의 요구량을 감소시킨다. 비스테로이드소염제의 주요 부작용으로는 위장관 출혈, 혈소판 억제로 인한 출혈, 신부전 등이 있다. 혈소판억제 작용 때문에 신경계 중환자실에서는 다른 중환자실에 비해 사용 빈도가 낮지만, 뇌졸중이나 출혈 문제가 없는 환자의 해열 진통 작용을 위해 사용해 볼 수 있다.
(4) 아세트아미노펜과 tramadol
아세트아미노펜(paracetamol)은 경도나 중등도의 급성 통증과 발열에 투여해 볼 수 있는 약제이다. 통증 조절에 이 약제를 처방함으로써 아편유사진통제의 요구량을 감소시킬 수 있다. 이는 항염증 효과가 없어 비스테로이드소염제로 분류되지 않으며, 혈소판 억제 작용이 없고 위장장애가 적다. 경구(아세트아미노펜, paracetamol) 또는 정맥 주사(propacetamol HCL)로 투여 가능하다. Propacetamol을 정맥 주사하면 가수분해를 통해 50% 용량의 아세트아미노펜으로 전환된다. 장기적으로 사용하거나 과용량으로 투여할 경우 간독성을 유발할 수 있으며, 와파린(warfarin)과 약물 상호작용을 일으켜 프로트롬빈시간(prothrombin time)을 연장시킬 수 있으므로 주의가 필요하다. 아세트아미노펜은 해열 진통 작용외에도 오한을 조절하는 효과가 있다. 이 때문에 TTM 치료 시 오한 예방을 위해 투여할 수 있다[31].
Tramadol은 중추신경에서 µ-opiate 수용체에 결합하고, 세로토닌과 노르에피네프린의 재흡수를 억제함으로써 진통작용을 나타내는 비마약성 진통제이다. 부작용으로 경련의 역치를 낮출 수 있고, 호흡억제의 부작용도 있으므로 주의가 필요하다. 경구 제제로 아세트아미노펜과 tramadol은 상승작용이 있기 때문에 복합성분 제재가 판매되고 있다.
2) 진정제
중환자실에서 자주 사용되는 진정제로는 propofol, dexmedetomidine, 벤조디아제핀 (디아제팜, lorazepam, 미다졸람) 등이 있다. Table 5는 이들의 약리학적 특성을 정리한 표이다[3, 26,27]. Table 4에서 벤조디아제핀 종류별로 역가를 대략적으로 정리했다.
(1) Propofol
Propofol은 지질(lipid formulation) 특성으로 인해 정맥 투여 후 신속하게 혈액뇌장벽(blood-brain barrier)을 통과하여 빠른 진정 효과를 나타내는 약제이다. 중환자에서 지속주입을 통해 진정 효과를 얻을 수 있는데, 지속주입을 중단하면 다른 약제에 비해 신속하게 의식이 회복된다. Propofol은 간에서 불활성 대사물로 전환되어 신장으로 배설되며, 제거반감기(elimination half life)는 3-12시간이다. 실제로는 이 보다 더 빨리 약효가 나타나고 사라지는 이유는 강한 지용성으로 인하여 혈액뇌장벽 투과율이 높기 때문이다. 지용성이므로 말초 조직으로의 재분포도 빠르지만, 장기 투여 시에는 말초 조직에서 포화되므로 약효가 연장된다. 강력한 뇌기능(electrical, metabolic) 억제 효과를 가지며, 간부전이나 신부전 환자에서도 유의한 약물역동학의 변동은 보고되지 않았다[27,32]. Propofol은 뇌대사율을 낮추고 뇌압을 감소시키는 효과가 있기 때문에 뇌압상승 환자에게 유용하다. 또한, 강력한 항경련효과로 인해 뇌전증지속상태의 환자에게 처방 가능하다. 또한, TTM 시에 오한을 억제하는 효과가 좋은 편이다. 반면, 주요 부작용으로 강한 혈관 확장과 혈압 강하가 있는데, 특히 약덩이로 급속히 주입하거나, 저혈량(hypovolemia) 환자에게 주입하는 경우 저혈압이 자주 발생한다. 이외에도 고칼로리, 고중성지질혈증, 근간대경련(myoclonus) 등의 부작용이 있다. 특히 고용량의 propofol을 장기간 투여하는 경우 propofol infusion syndrome이 문제가 될 수 있어 4-5 mg/kg/hr 이상의 주입 속도로 48시간 이상 사용하는 것은 바람직하지 않다. Propofol infusion syndrome은 고칼륨혈증, 간비대, 고중성지질혈증, 대사산증, 횡문근융해, 불응서맥, 심근 억제, 신부전을 특징으로 하며 사망율이 높다. 중환자의 진정 목적으로 propofol과 dexmedetomidine의 사용을 비교한 연구에 의하면, 두 약제 모두 비슷한 빈도로 심각한 저혈압과 서맥(bradycardia) 부작용을 발생시켰다[33]. 간혹 propofol의 페놀 대사산물(phenolic metabolite)이 소변으로 배출되기 때문에 소변 색깔이 초록색으로 변하는 경우가 있다. 이 자체가 위험한 부작용은 아니지만, 이에 대해 불필요한 검사를 하지 않는 것과 용량을 줄이는 조치를 취하는 것이 바람직하다[34,35].
(2) Dexmedetomidine (Precedex®)
Dexmedetomidine은 중추신경계의 α2 수용체 작용제로서 진정 효과와 진통 효과가 있는 약제이다. 다른 진정제와는 달리 유의한 호흡억제가 없고, 약제 지속 주입 중에도 비교적 쉽게 환자의 각성을 유도할 수 있으며, 기억상실(amnesia) 부작용이 없다는 점에서 dexmedetomidine이 다른 진정 진통제와 구분되는 유용한 약제로 알려져 있다. 따라서, 기관삽관이나 인공호흡기를 적용하지 않고 환자를 진정시키고자 할 경우나, 진정 상태에서도 자주 신경학적진찰을 시행해야 할 경우 특히 유용한 약제이다. 하지만, 저자들은 인공호흡기를 적용하는 환자에서 dexmedetomidine 투여 후 자발호흡 유발(trigger)이 사라지는 정도의 호흡억제 또는 뇌졸중 환자에서 마비 등 기존 신경계장애가 일시적으로 악화되는 정도의 부작용을 경험하였다. 또한 미다졸람에 비해 섬망을 덜 유발하므로, 섬망이 있거나 발생위험이 높은 환자에서 유용하게 사용될 수 있다[6]. 이 약물의 반감기는 약 2시간으로 짧지만, 간부전 환자에서는 연장될 수 있다. 초기 주입 시 일시적으로 혈압이 감소하거나 오히려 상승하는 경우가 있다. 이 때문에 부하용량 없이 곧바도 유지용량을 처방하기도 한다. 부작용으로 서맥이나 저혈압이 흔하기 때문에 서맥, 부정맥, 심부전, 저혈량, 저혈압 환자에게 투여할 때는 주의가 필요하다. 반면, 이러한 약리작용은 발작적인 고혈압, 빈맥, 빠른호흡, 발한, 발열, 근긴장이상(dystonic posturing)을 특징으로 하는 발작교감활성증(autonomic storming, paroxysmal sympatheic hyperactivity) 환자에서 고혈압, 빈맥, 초조 증상을 조절함에 있어서 효과적이다[36]. Dexmedetomidine은 기관 삽관을 하지 않은 중환자에서도 사용될 수 있을 뿐만 아니라, 발관(extubation)에 따른 환자의 불편감을 줄이고 발관 이후 진정 진통이 필요한 경우에도 유지할 수 있다. 아울러, TTM 시에 오한을 감소시키는 효과가 좋은 편이다. 또한 섬망, 알코올금단증후군, 발작교감과 활성증에 효과가 있다[36,37]. Dexmedetomidine 투여 시 침분비가 억제되는 작용이 있다. 중증근무력증위기(myasthenia gravis crisis) 상황이나 길랑-바레증후군에서 인공호흡기를 유지해야 할 경우 침분비가 문제되는 경우가 많다. 저자의 경험으로는, 이러한 환자들에서 dexmedetomidine을 처방하여 얕은 진정을 유도하며 인공호흡기를 pressure support ventilation (PSV) mode나 synchronized intermittent mandatory ventilation (SIMV) mode로 유지하는 것이 유용하다. 지금까지 언급한 약리작용을 고려할 때, dexmedetomidine은 신경계 중환자에서 활용 가능성이 높은 진정제로 판단된다.
(3) 벤조디아제핀
미다졸람 과 lorazepam은 중환자실에서 많이 처방되는 벤조디아제핀 계열 진정제이다. 미다졸람은 다른 벤조디아제핀 계열 약물들에 비해 작용시간이 빠르고 배설 반감기가 짧다. 소실이 빠른 약제이지만 중환자에서 장기간 사용시 지방 조직에 축적되어 진정 상태가 지속되고 각성이 지연될 수 있으며, 간부전이나 신부전 환자에서도 반감기가 연장될 수 있다. Lorazepam은 미다졸람과 달리 신부전이나 간부전에 영향을 받지 않는다. 이는 장기적으로 진정이 필요한 환자에서 투여를 시도해 볼 수 있으며, 이를 위해 간헐적 약덩이 투여가 선호된다. 미다졸람과 달리, lorazepam의 지속 주입은 propylene glycol 독성으로 인해 심한 대사산증을 유발할 수 있기 때문에 추천되지 않는다. Lorazepam은 미다졸람에 비해 상대적으로 약효 발현이 느린 편이며, 약물이 말초에 축적되어 약효가 연장될 수 있다. 디아제팜은 작용 발현이 빠르고 근육이완 효과가 있다. 하지만, 긴 반감기와 혈압강하 등의 부작용으로 중환자 진정 목적으로는 잘 사용되지 않는다. 벤조디아제핀 약덩이 투여는 간헐적인 초조를 조절하기 위해 시도해 볼 수 있지만, 지속 주입은 기계환기 기간을 연장하는 바람직하지 않은 결과를 초래한다[38]. 벤조디아제핀은 혈액량이 감소한 환자에서 저혈압을 유발할 수 있고 섬망 발생의 위험이 있으며 투여 기간이 길어질수록 약제 내성이 발현한다. 따라서, 금단증상, 알코올금단증상, 진전섬망, 경련 등을 조절하는 경우가 아니라면, 단순한 진정을 목적으로 중환자에게 벤조디아제핀을 투여하는 것은 추천되지 않는다. 벤조디아제핀의 해독제는 flumazenil이다. 하지만, 뇌전증 환자 또는 경련 역치가 감소한 환자에게서 경련 발생 위험이 있기 때문에 이러한 환자에게 flumazenil을 투여할 때에는 주의가 필요하다.
(4) 바비튜르산염(barbiturate)
바비튜르산염은 뇌압조절이나 뇌전증지속상태를 치료하기 위해 신경계 중환자실에서 간혹 처방된다. 펜토바르비탈(pentobarbital) 부하용량 5 mg/kg을 15-30분에 걸쳐 (최대 50 mg/min) 정맥 주입 후 유지용량 1–5 mg/kg/hr을 투여한다. 돌발파억제(burst-suppression)를 유지하는데, 일반적으로 뇌파 모니터링을 시행하며 6-8 초마다 interburst가 나올 정도로 펜토바르비탈 용량을 조절하면 된다. 이는 뇌혈류량을 감소시킬 뿐만 아니라 뇌산소소비량과 당 대사 감소를 통해 뇌대사율을 낮춘다[39]. 외상성뇌손상 환자를 대상으로 한 연구에서 펜토바르비탈 혼수요법(coma therapy)을 받는 경우 에너지 소비량이 유의하게 낮아졌다[40]. 따라서, 펜토바르비탈 혼수요법을 시행할 때에는 영양 칼로리도 재조정할 필요가 있다. 부작용으로는 심장기능억제, 저혈압, 위정체, 대사산증, 혈소판감소증 등이 있다.
결 론
중환자는 통증과 초조에도 불구하고 의식 변화, 마비, 기도 삽관 등으로 인해 자신의 고통을 호소하지 못하는 경우가 많다. 따라서, 중환자를 치료하는 의료진은 환자의 불편감을 확인하고 이를 해결해 주기 위해 많은 노력을 기울여야 한다. 이를 효과적으로 실행하기 위해 각종 평가 지표와 프로토콜이 도움이 될 수 있다. 평가된 통증과 초조에 대해서는 원인을 파악하여 해결해 주어야 하며, 비약물적 처치를 우선적으로 시도하여야 한다. 하지만, 많은 경우에 있어서 약물 치료가 결국 필요하다. 약물을 처방하기에 앞서서 진정 수준 목표를 미리 설정해야 한다. 일반적으로 얕은 진정을 목표로 하는 것이 환자의 예후를 호전시킬 가능성이 더 높으므로 바람직하다. 하지만, 뇌압상승, 뇌전증지속상태, 혈역학적불안정 등의 불안정한 상황에서는 깊은 진정이 필요할 수 있다. 따라서, 진통과 진정 목표를 효과적으로 달성하기 위해서는 환자의 전신 상태를 고려하여 적합한 약제를 선택해야 한다. 이를 위해, 중환자 의료진은 진통제와 진정제의 사용 원칙과 각 약제들이 가지는 약리학적 특성을 숙지해야 한다.